Il gruppo di coordinamento per i dispositivi medici (gruppo MDCG) pubblica una bozza del modulo relativo alle relazioni sulle tendenze e una serie di linee guida

Il sottogruppo MDCG sulla sorveglianza post commercializzazione e sulla vigilanza ha pubblicato la bozza del modulo sulle relazioni sulle tendenza e alcune linee guida: qui.
Questi documenti, insieme ai verbali della riunione, sono stati caricati la settimana scorsa.
N.B.: Tutti i documenti menzionati sono bozze. Non sono stati ufficialmente pubblicati sul sito della Commissione. Le versioni finali potrebbero essere diverse, ma condividiamo le bozze ora per dare ai lettori una visione anticipata di ciò che è in fase di sviluppo.
Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
Modulo sulla Relazione sulle tendenze del fabbricante
La bozza del modulo sulla Relazione sulle tendenze del fabbricante (Manufacturer Trend Report, MTR) è disponibile qui.
Questa bozza è stata creata per supportare la futura relazione sulle tendenze di EUDAMED. Tuttavia, viene condivisa in anticipo per aiutare i fabbricanti con la segnalazione delle tendenze fino a quando EUDAMED non sarà del tutto operativa.
Fino a quando EUDAMED non sarà pronta, i fabbricanti dovrebbero inviare il modulo all'autorità competente secondo i documenti MDCG 2021-1 (MDR) e MDCG 2022-12 (IVDR).
Una volta pubblicato formalmente, il modulo in versione MDR/IVDR sostituirà la versione MEDDEV.
Sarà inoltre reso disponibile un testo di aiuto riguardo alla relazione sulle tendenze (MTR), per supportare i fabbricanti durante la compilazione del modulo.

Immagine estratta dal documento interno del gruppo MDCG intitolata “TF TREND REPORT PMSV Febbraio 2025”.
Linee guida MDCG (Q&A) relative alle relazioni sulle tendenze
La bozza è disponibile qui.
N.B.: visto che non è ancora stata pubblicata formalmente, la denominazione del doucmento è “MDCG 2025-X”. La versione finale potrebbe differire dalla bozza.

Immagine estratta dal documento interno del gruppo MDCG intitolata “TF TREND REPORT PMSV Febbraio 2025”.
Tra gli argomenti che sono stati trattati:
- cosa si intende per “un impatto significativo sull'analisi del rapporto benefici-rischi” e “aumento significativo”;
- come segnalare una tendenza relativa a “effetti collaterali indesiderati attesi” o “risultati errati attesi”,
- come la relazione sulle tendenze è legatta a un piano di sorveglianza post-commercializzazione (PMS) e a un sistema di gestione della qualità (QMS);
- quali sono i documenti necessari per presentare una relazione sulle tendenze in EUDAMED;
- come i fabbricanti dovrebbero applicare i requisiti della relazione sulle tendenze ai dispositivi su misura;
- esempi di situazioni in cui un fabbricante dovrebbe presentare una relazione sulle tendenze (vedi tabella sotto).
| Regolamento | Tipo | Oggetto di relazione sulla tendenza | Possibile motivazione |
|---|---|---|---|
| 2017/745 (MDR) | Aumento della frequenza | Aumento della frequenza di eruzioni cutanee causate da cerotti adesivi. | Un aumento statisticamente significativo della frequenza di incidenti non gravi, rispetto alla frequenza dichiarata nella documentazione tecnica, può indicare un rischio per la sicurezza del paziente che supera il benefici previsto. |
| Aumento della gravità | Eventi di irritazioni oculari non gravi causati da un dispositivo oftalmico che si aggravano in abrasioni corneali. | Un aumento significativo della gravità di incidenti non gravi suggerisce una deviazione dall'analisi dei rischi e dei benefici del dispositivo riportata nella documentazione tecnica e potrebbe causare rischi inaccettabili per i pazienti. | |
| Aumento della frequenza o della gravità degli effetti collaterali indesiderati attesi | Eventi di dolore addominale e nausea dopo l'impianto di una spirale contraccettiva. | Un aumento statisticamente significativo della frequenza o gravità degli effetti collaterali indesiderati attesi, rispetto ai livelli previsti nella documentazione tecnica, comporta un rischio inaccettabile per i pazienti previsti. | |
| 2017/746 (IVDR) | Aumento della frequenza | Aumento dei risultati invalidi di un test del colesterolo, dove i test invalidi superano il 5% del totale. | Un aumento statisticamente significativo dei risultati invalidi influisce sulle prestazioni del dispositivo rispetto alle specifiche contenute nella documentazione. |
| Aumento della gravità | Risultati falsi positivi di un test della vitamina B12 che portano a iniezioni innecessarie. | Un aumento della gravità di risultati errati influisce sull'analisi dei rischi e dei benefici, esponendo i pazienti a interventi non necessari. | |
| Aumento della frequenza o della gravità degli effetti collaterali indesiderati attesi | Aumento dei risultati falsi negativi di un test delle proteine urinarie, causando ritardi nell'identificazione preoce della disfunzione renale. | Un aumento statisticamente significativo della frequenza di risultati errati attesi rispetto alle prestazioni dichiarate porta a rischi inaccettabili per i pazienti. |
Tabella riportata nella bozza delle linee guida (pag. 19-20).
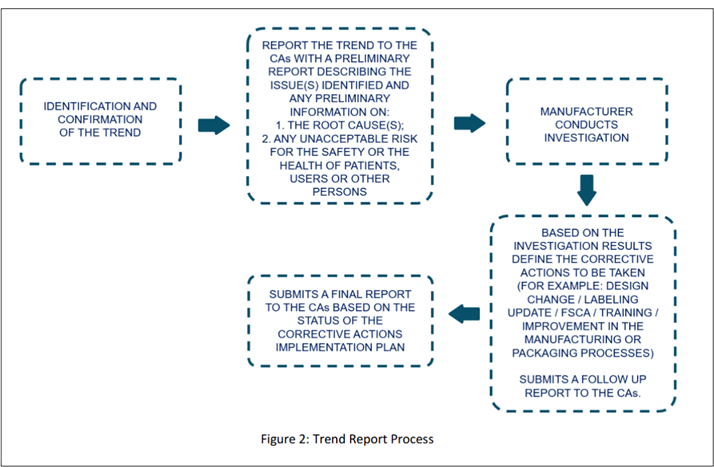
Immagine estratta dallla bozza delle linee guida (pag. 15).
Documento di relazione sulle tendenze da parte del fabbricante
La bozza è disponibile: qui
I fabbricanti dovrebbero utilizzare questo documento per fornire dettagli aggiuntivi che non possono essere inseriti nel modulo MTR.
Include quattro sezioni:
- Descrizione dei dispositivi interessati dalla tendenza
- Descrizione della tendenza
- Analisi del fabbricante riguardo a una tendenza potenzialmente da segnalare
- Azioni correttive
Il modello fornisce sia indicazioni pratiche (ad esempio, come presentare la documetazione prima che EUDAMED funzioni), sia tecniche (ad esempio, tipo e livello di informazioni attese).
Segnalazione di incidenti gravi e di azioni correttive di sicurezza
Il verbale della riunione riporta che:
- La guida sugli incidenti gravi è in fase di sviluppo. Questo è un nuovo documento sulle aspettative e sulle buone pratiche dell’autorità competente. Al momento della riunione, i commenti dell'autorità competente erano stati implementati.
- Il rapporto relativo alle azioni correttive di sicurezza aggiornato è in fase di sviluppo e si prevede che verrà finalizzato verso la fine del 2025.

Questo articolo è stato originariamente scritto in inglese da Casus Consulting. Questa versione è una traduzione di AbroadLink dell'originale in inglese: MDCG Working Group Releases Draft Version of Manufacturer Trend Report Form & Guidance Docs. Puoi accedere all'originale pubblicato sul sito di Casus Consulting cliccando sul titolo dell'articolo.



Aggiungi un commento