Organismi notificati in Europa: sempre troppo pochi di fronte alla sfida dell’MDR/IVDR

Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
- Il paradosso: una domanda crescente, ma un'offerta limitata
- Promemoria normativo: MDR, IVDR e il ruolo degli organismi notificati
- Alcune cifre chiave
- Il punto di rottura: perché la mancanza di ON è un rischio sistemico
- Proiezioni: cosa aspettarsi per il 2028
- Conseguenze per i fabbricanti e per PRRC e QARA
- Cosa si può fare per migliorare la situazione
- Inizia il conto alla rovescia
Il paradosso: una domanda crescente, ma un'offerta limitata
Con l'entrata in vigore del Regolamento (UE) 2017/ 745 relativo ai dispositivi medici (MDR) e del Regolamento (UE) 2017/746 (IVDR) relativo ai dispositivi medico-diagnostici in vitro, tutti i fabbricanti di dispositivi medici devono passare prima dagli organismi notificati (ON). Ogni prodotto, o famiglia di prodotti, deve essere certificato nel rispetto del regolamento per poter essere commercializzato nel mercato europeo. Tuttavia, il numero degli organismi notificati continua a essere insufficiente e incapace di assorbire il flusso di richieste.
Promemoria normativo: MDR, IVDR e il ruolo degli organismi notificati
— L’MDR è entrato in vigore il 26 maggio 2021 e sostituisce le vecchie direttive.
— L’IVDR è entrato in vigore nel 2022.
— Gli organismi notificati sono entità abilitate a effettuare le valutazioni di conformità, specialmente per i prodotti di classe più alta, valutare la documentazione tecnica, realizzare audit dei sistemi di gestione della qualità, ecc.
Alcune cifre chiave
Secondo MedTech Europe, il settore dei dispositivi medici e di quelli in vitro in Europa si basa su:
- circa 38.000 aziende;
- oltre 500.000 prodotti in circolazione nel 2025 (di cui almeno l'80 % è ancora sotto le direttive europee 93/42/CEE e 98/79/CE).
La transizione verso l’MDR e l’IVDR
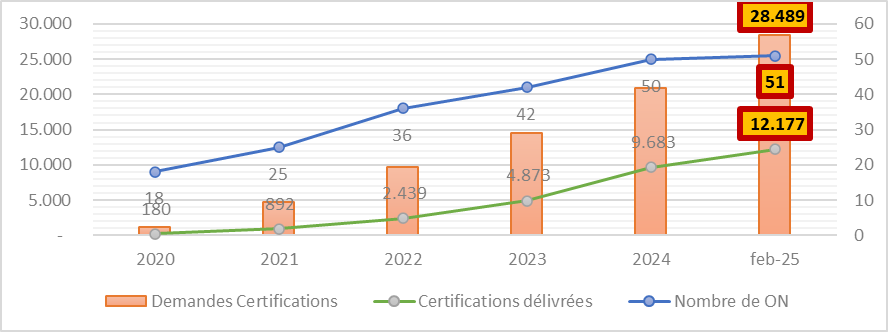
A febbraio 2025, secondo i dati evidenziati dalla Commissione europea, i 51 organismi notificati ufficialmente designati si sono ritrovati a dover gestire un numero di richieste di certificazione che ammontava a 28.500. In quel momento vennero rilasciati oltre 12.000 certificati, cioè il 43%.
Tuttavia, devi sapere anche che:
- si impiega in media tra i 13 e i 18 mesi affinchè un fascicolo ottenga la certificazione;
- quando vengono presentati fascicoli incompleti, il tempo richiesto è maggiore;
- i fascicoli possono essere rifiutati e, in quel caso, è necessario presentarli nuovamente.
Il punto di rottura: perché la mancanza di ON è un rischio sistemico
— Il collo di bottiglia: gli ON esistenti sono sopraffatti dalle richieste e le loro risorse sono limitate.
— Aumenta la complessità delle normative: rispetto alle direttive precedenti, l'MDR stabilisce requisiti più severi (clinici, di sorveglianza post-commercializzazione, di documentazione rafforzata), il che aumenta il carico di lavoro di ogni fascicolo.
— Fascicoli incompleti o mal preparati: è una perdita di tempo prezioso per gli ON e i fabbricanti.
— Rischio di carenza di prodotti nel mercato europeo se i fabbricanti non riescono a ottenere la loro certificazione in tempo (ritardo nell'accesso al mercato). Uno dei motivi per cui si estende il periodo di transizione è proprio quello di evitare ritardi.
— La pressione temporale aumenta: la scadenza della certificazione completa è prevista per il 2028, ciò significa che il tempo a disposizione per la transizione è sempre meno.
Proiezioni: cosa aspettarsi per il 2028
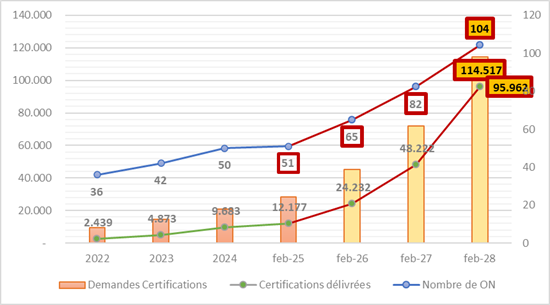
Ipotesi 1: Basandoci sul ritmo in cui sono stati designati gli organismi notificati tra il 2022 e il 2025, potremmo aspettarci di passare dagli attuali 51 a circa 85 ON entro la fine del 2027 e oltre 100 nel 2028. Ma questo dipende in gran parte da scelte politiche, dagli investimenti nazionali e dalla capacità di accreditamento.
Ipotesi 2: Sempre in base alle evoluzioni a partire dal 2022, il numero di richieste raggiungerebbe almeno 114.000. Tuttavia, questa cifra dovrebbe essere ancora più alta, poiché circa 400.000 prodotti dei 500.000 attualmente in circolazione devono sottostare al regolamento. Tutto ciò nonostante nonostante i possibili raggruppamenti per «famiglia di prodotti» (altrimenti, 1 prodotto = 1 fascicolo).
Ipotesi 3: Secondo il ritmo attuale delle certificazioni, si può stimare che verranno emessi 95.000 certificati nel 2028. Un numero che non raggiunge i 114.000 fascicoli possibili nemmeno nel migliore dei casi.
Risultati delle proiezioni: se si arriva veramente a 104 ON nel 2028 e se si raggiunge anche il numero di certificati emessi, significa che ogni ON avrà 919 certificati da emettere. È fattibile?
Conseguenze per i fabbricanti e per PRRC e QARA
Coloro che si occupano del rispetto della normativa (PRRC) e gli specialisti in QARA sentono la pressione. I diversi fattori di cui abbiamo parlato prima (tempo, budget, requisiti normativi, ecc.) complicano il loro lavoro. Questo perché:
— selezionare un’ON diventa una sfida strategica: bisogna tenere in considerazione disponibilità, tempi, competenza, tariffe, specializzazione per tipo di prodotto;
— una pianificazione proattiva è indispensabile: iniziare in anticipo la preparazione dei fascicoli, sfruttare gli audit preliminari, assicurarsi che la documentazione sia completa e conforme;
— esiste un rischio di ritardo nei lanci: un prodotto pronto deve aspettare la valutazione del fascicolo da parte dell'ON per poter entrare nel mercato;
— a volte bisogna ricorrere a ON stranieri (per costi o logistica);
— sanno quanto è importante avere un rapporto stabile con l’ON per gli audit di sorveglianza, i rinnovi, eventuali modifiche nell’ambito, ecc.
Nonostante gli sforzi delle diverse parti interessate, la complessità dei requisiti del regolamento e la mancanza evidente di ON rendono sempre più difficile questo compito. Gli ON e gli altri attori del settore interpellano regolarmente le autorità per segnalare le carenze strutturali e avvertire sull'effetto che possono avere lo strangolamento e la carenza.
Cosa si può fare per migliorare la situazione
Non esiste una soluzione miracolosa. Se l'Europa vuole evitare una grave carenza di dispositivi medici, deve agire rapidamente, tenendo in considerazione le seguenti proposte:
— incoraggiare gli Stati membri a designare più ON e a mantenere un certo ritmo nel tempo;
— armonizzare e semplificare alcune fasi del processo di valutazione per alleggerire il carico amministrativo (forse rivedendo alcuni requisiti?);
— rafforzare la formazione di auditor esperti MDR/IVDR per aumentare il set di competenze disponibili;
— assicurarsi che la documentazione dei fabbricanti rispetti la normativa per evitare possibili rifiuti amministrativi (con spiegazioni chiare e precise di ciò che è richiesto);
— stabilire un termine legale di risposta per gli ON (?)
— promuovere la collaborazione tra ON, agenzie nazionali e associazioni delle imprese per gestire al meglio il carico di lavoro.
Inizia il conto alla rovescia
La scarsa presenza di organismi notificati in Europa rimane uno dei principali ostacoli e impedisce una transizione scorrevole verso un mercato pienamente conforme ai Regolamenti (UE). Per i fabbricanti, cosí come per le PRRC e i QARA, questa realtà obbliga ad adottare una strategia rigorosa, anticipata e resiliente. Se vengono designati nuovi ON, deve aumentare realmente anche la capacità e l’efficienza per evitare così il rischio di un collasso generalizzato nel 2028.
Ultime cifre aggiornate a ottobre 2025 :
- Numero di organismi notificati per il Regolamento UE 2017/745 relativo ai dispositivi medici : 51
- Numero di organismi notificati per il Regolamento UE 2017/746 relativo ai dispositivi medico-diagnostici in vitro: 19
Riferimenti
- Commissione europea – Study supporting the monitoring of the availability of medical devices on the EU market, 2025.
https://health.ec.europa.eu/document/download/59b9d90e-be42-4895-9f6f-bec35138bb0a_en?filename=md_nb_survey_ - MedTech Europe – The European Medical Technology Industry in figures, 2025.
- Commissione europea – Sistema Informativo NANDO (New Approach Notified and Designated Organisations).
https://webgate.ec.europa.eu/single-market-compliance-space/notified-bodies
Forse potrebbero interessarti anche questi altri articoli:

Con una formazione in Marketing e Commercio Internazionale, Alex ha sempre mostrato un interesse per le lingue e le diverse culture. Originario della Bretagna, in Francia, ha vissuto in Irlanda e in Messico prima di tornare per un periodo in Francia e poi stabilirsi definitivamente in Spagna. Lavora come Chief Growth Officer in AbroadLink Translations.



Aggiungi un commento